今日�,傳奇生物宣布�,美國FDA已接受楊森(Janssen)公司為靶向B細(xì)胞成熟抗原(BCMA)的CAR-T療法ciltacabtagene autoleucel(cilta-cel)提交的生物制品許可申請(BLA)。FDA同時授予其優(yōu)先審評資格��,預(yù)計在今年11月29日之前做出回復(fù)���。
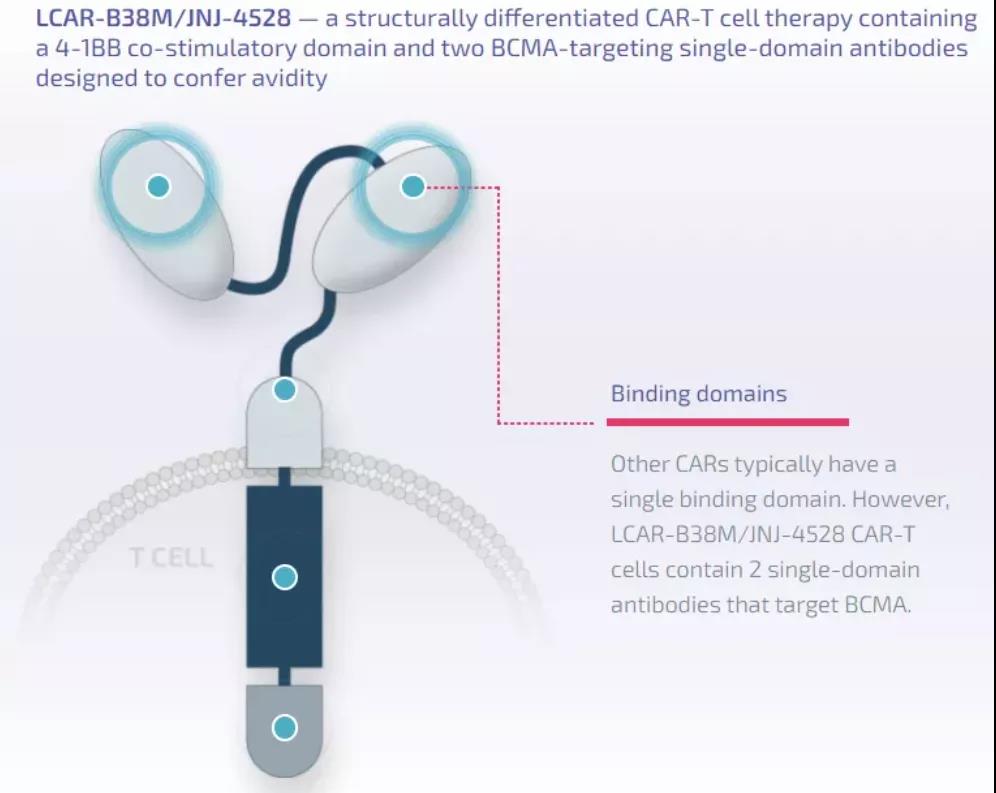
Cilta-cel是一種具有差異性結(jié)構(gòu)的CAR-T細(xì)胞療法���,包含一個4-1BB共刺激結(jié)構(gòu)域和兩個靶向BCMA的抗體結(jié)構(gòu)域,具有促進(jìn)CD8陽性T細(xì)胞擴(kuò)增的能力��。BCMA是一種在骨髓瘤細(xì)胞上高度表達(dá)的蛋白�。2017年12月,楊森生物技術(shù)有限公司與傳奇生物達(dá)成全球獨(dú)家許可和合作協(xié)議�����,共同開發(fā)和商業(yè)化cilta-cel����。▲Cilta-cel(又名為JNJ-4528/LCAR-B38M)的結(jié)構(gòu)示意圖(圖片來源:傳奇生物官網(wǎng))Cilta-cel的監(jiān)管提交是基于關(guān)鍵性1b/2期CARTITUDE-1研究的結(jié)果。在去年舉行的美國血液學(xué)會年會上公布的臨床數(shù)據(jù)顯示����,cilta-cel持續(xù)表現(xiàn)出非常高的總緩解率(ORR)�����,在中位隨訪時間為12.4個月時��,ORR達(dá)到97%�,而且隨著時間的推移�,患者的緩解程度進(jìn)一步加深,67%的患者達(dá)到嚴(yán)格的完全緩解�����。研究人員將在下個月召開的美國臨床腫瘤學(xué)會(ASCO)年會(摘要#8005)和歐洲血液學(xué)協(xié)會(EHA)虛擬大會(摘要#EP964)上更新長期隨訪數(shù)據(jù)�����。“迄今為止的研究結(jié)果顯示�,cilta-cel在治療經(jīng)過多種前期療法治療的多發(fā)性骨髓瘤患者方面顯示出巨大的前景�。今天的優(yōu)先審評資格標(biāo)志著這一細(xì)胞療法的又一個重大里程碑?!眰髌嫔锏氖紫瘓?zhí)行官兼首席財務(wù)官黃穎博士說,“我們期待著繼續(xù)與楊森合作�����,并與美國FDA合作,將這一變革性療法帶給需要新治療方案的患者�����?!?/span>
參考資料:
[1] U.S. Food and Drug Administration Grants BCMA CAR-T Cilta-cel Priority Review for the Treatment for Relapsed/Refractory Multiple Myeloma. Retrieved May 26, 2021, from https://www.businesswire.com/news/home/20210526006114/en