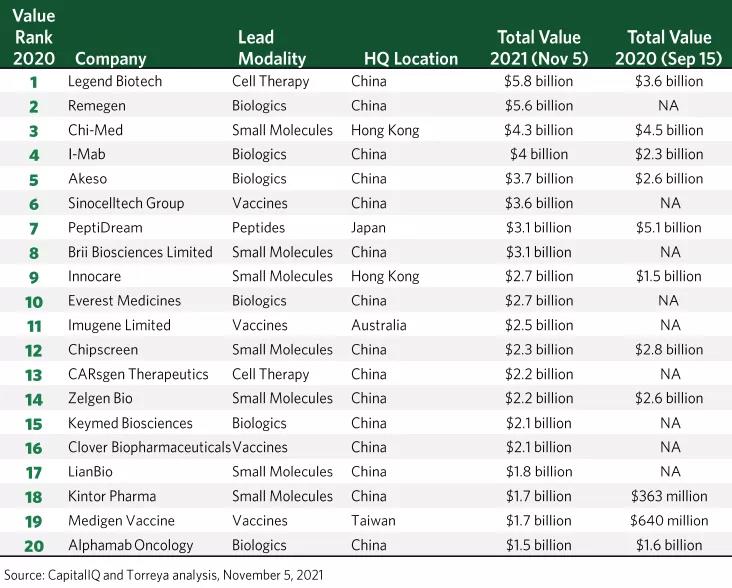
近日,全球知名投行Torreya發(fā)布了《全球1000強藥企報告》,按估值對全球前1000家藥企(Pharma)進行了排名�,Torreya還對亞洲生物醫(yī)藥(Biotech)公司估值進行了排名,評選出了前20強��。值得一提的是�����,這20強生物醫(yī)藥公司中的18家來自中國(含港澳臺地區(qū))��,前5強均為中國公司����,前10強中9家為中國公司。本文精選其中5家生物醫(yī)藥公司進行相關(guān)介紹��。榮昌生物成立于2008年����,總部位于中國山東煙臺,致力于研發(fā)針對自身免疫�����、腫瘤和眼科疾病的生物藥,公司聯(lián)合創(chuàng)始人�、首席執(zhí)行官兼首席科學(xué)官為房健民博士。自成立以來�,該公司已搭建了三大核心技術(shù)平臺,分別是抗體和融合蛋白平臺����、抗體偶聯(lián)藥物(ADC)平臺以及雙功能抗體平臺。去年11月�����,榮昌生物正式在港交所上市��;今年6月���,榮昌生物在科創(chuàng)板遞交首次公開募股(IPO)申請并獲得受理�;今年8月���,榮昌生物與Seagen達成一項總額最高達26億美元的全球獨家許可協(xié)議,共同開發(fā)和推廣榮昌生物自主開發(fā)的創(chuàng)新抗體偶聯(lián)藥物(ADC)維迪西妥單抗(disitamab vedotin)�����。目前,榮昌生物建立了包含十余種創(chuàng)新藥物的研發(fā)管線�����。在適應(yīng)癥方面����,這些在研產(chǎn)品覆蓋了胰腺癌、肺癌�、尿路上皮癌等多種實體瘤,以及濕性老年黃斑病變(wAMD)��、糖尿病黃斑水腫(DME)等�����。其核心產(chǎn)品泰它西普以及維迪西妥單抗分別于今年3月和今年6月經(jīng)優(yōu)先審評審批程序在中國獲附條件批準(zhǔn)上市�����,分別用于治療系統(tǒng)性紅斑狼瘡和胃癌�����。公開資料顯示,維迪西妥單抗是首款由中國公司自主研發(fā)并獲批上市的ADC��。天境生物成立于2016年����,總部位于中國上海,是一家處于臨床階段的創(chuàng)新生物藥公司�,聚焦腫瘤免疫治療和自身免疫疾病領(lǐng)域創(chuàng)新生物藥的早期發(fā)現(xiàn)、藥物開發(fā)和商業(yè)化�,以填補尚未滿足的重大醫(yī)療需求。天境生物已搭建四大抗體工程平臺����,包括抗體細胞因子平臺、雙特異性平臺����、長效hyFc蛋白平臺和單克隆抗體平臺,基于此設(shè)計具有特定生物學(xué)特性的藥物分子��。去年1月���,天境生物正式登陸納斯達克�����;去年9月�����,天境生物與艾伯維達成近30億美元合作��,共同開發(fā)和商業(yè)化其在研抗癌藥物——CD47單克隆抗體lemzoparlimab(TJC4)�����;今年11月���,天境生物與濟川藥業(yè)達成超20億元合作,開發(fā)和商業(yè)化伊坦生長激素(eftansomatropin alfa)��。目前�����,天境生物已搭建了十余條在研管線�����,其中1項將申報上市����,2項正在進行注冊性3期臨床試驗�����,7項正在進行2期臨床試驗�����,8項正在進行1期臨床試驗��,適應(yīng)癥涵蓋多發(fā)性骨髓瘤����、膠質(zhì)母細胞瘤�、兒童生長激素缺乏癥等。其先導(dǎo)候選藥物TJ202是一款差異化CD38抗體�,擬用于治療多發(fā)性骨髓瘤和系統(tǒng)性紅斑狼瘡等。該藥是天境生物現(xiàn)有研發(fā)管線中首個即將達到注冊性臨床試驗終點的產(chǎn)品����,適用于多發(fā)性骨髓瘤的三線治療,預(yù)計于今年第四季度在中國提交新藥上市申請����。伊坦生長激素是一款差異化長效重組人生長激素�����,擬用于治療兒童生長激素缺乏癥。今年2月�,伊坦生長激素完成中國注冊性3期臨床試驗的首例患者給藥,預(yù)計將于2023年提交新藥上市申請�。康方生物成立于2012年,總部位于中國廣東�����,是一家創(chuàng)新型生物醫(yī)藥公司�,致力于發(fā)現(xiàn)和開發(fā)具有自主知識產(chǎn)權(quán)的創(chuàng)新型抗體新藥,以滿足全球醫(yī)藥市場的需求���。康方生物已建成生物醫(yī)藥全程研發(fā)及產(chǎn)業(yè)化平臺�,建立了針對腫瘤���、自身免疫性疾病�����、炎癥和心血管疾病的產(chǎn)品線���。去年4月�,康方生物正式在港交所上市���,實現(xiàn)了約639.2倍的超額認(rèn)購���,為2020年港股募資第一名。值得一提的是����,這是康方生物第二次入選“亞洲最具價值TOP20生物醫(yī)藥公司”榜單。目前��,康方生物建立了20多個創(chuàng)新抗體藥物開發(fā)項目�����,其中9個抗體處于臨床階段��,6個雙特異性抗體(兩個處于臨床階段)及5個抗體獲得FDA的新藥臨床試驗(IND)申請批準(zhǔn)�。在適應(yīng)癥方面,這些在研產(chǎn)品覆蓋了非小細胞肺癌�����、肝癌、胃癌��、宮頸癌等實體瘤和血液瘤�,系統(tǒng)性紅斑狼瘡、銀屑病等自身免疫性疾病和其他�?�?捣缴餄撛凇癴irst-in-class”的PD-1/CTLA-4雙特異性抗體凱得寧單抗治療宮頸癌的上市申請已經(jīng)獲得中國國家藥品監(jiān)督管理局(NMPA)受理�,并獲優(yōu)先審評。根據(jù)新聞稿���,這意味著�,凱得寧單抗成為全球第一個遞交上市申請的基于PD-1的雙特異性抗體藥物�����。另外�,該公司自主研發(fā)的差異化PD-1單克隆抗體藥物安尼可(派安普利單抗)已于今年8月在中國正式獲批上市,治療霍奇金淋巴瘤�;同時,派安普利在中國治療鱗狀非小細胞肺癌和鼻咽癌�、在美國治療鼻咽癌的上市申請均已經(jīng)成功遞交�。諾誠健華成立于2015年���,總部位于中國北京����,是一家商業(yè)化階段的生物醫(yī)藥公司����,專注于惡性腫瘤及自身免疫性疾病治療領(lǐng)域的一類新藥研發(fā),適用于治療中國病人高發(fā)的淋巴瘤��、肝癌���、膽管癌�����、尿路上皮癌等多種惡性腫瘤及自身免疫性疾病��。該公司目前已搭建了完整的研發(fā)平臺�,覆蓋從藥物發(fā)現(xiàn)到臨床開發(fā)的全研發(fā)鏈條���。去年3月����,諾誠健華正式在港交所上市;今年3月�����,諾誠健華發(fā)布公告擬赴科創(chuàng)板上市���。今年10月����,諾誠健華科創(chuàng)板IPO獲問詢����,有望登陸上交所科創(chuàng)板���。諾誠健華產(chǎn)品管線已深度布局血液瘤�����、實體瘤和自身免疫性疾病領(lǐng)域�,快速推進源頭創(chuàng)新和全球臨床試驗�。去年12月��,諾誠健華研發(fā)的BTK抑制劑奧布替尼正式獲得中國NMPA批準(zhǔn)上市��,用于套細胞淋巴瘤(MCL)和慢性淋巴細胞白血?��。–LL)/小淋巴細胞淋巴瘤(SLL)。這是該公司首款獲批上市的創(chuàng)新藥�����,標(biāo)志著公司從臨床開發(fā)全面進入商業(yè)化階段���。另外�,諾誠健華還有4款在美國獲批臨床的創(chuàng)新藥�,最新獲批的為新型蛋白酪氨酸磷酸酶SHP2變構(gòu)抑制劑ICP-189。同時�����,該公司的還有多款創(chuàng)新藥在中國獲批臨床��,包括CD20xCD3雙特異性抗體CM355���、新型多靶點受體酪氨酸激酶(RTK)抑制劑ICP-033等�����。5.科濟藥業(yè)(CARsgen Therapeutics)科濟藥業(yè)成立于2014年��,總部位于上海�����,是一家聚焦于CAR-T細胞�、抗體等腫瘤免疫治療藥物的創(chuàng)新型生物醫(yī)藥企業(yè)。自成立以來�����,科濟藥業(yè)已內(nèi)部開發(fā)多項新技術(shù)以及擁有全球權(quán)益的產(chǎn)品管線��,以解決CAR-T細胞療法面臨的重大挑戰(zhàn)�,比如提高安全性�����、提高實體瘤的療效等�����。就CAR-T細胞療法而言,科濟藥業(yè)已經(jīng)在中國��、美國�����、加拿大獲得一共7個IND批件����。去年11月,科濟藥業(yè)宣布完成了由正心谷資本領(lǐng)投的1.86億美元C輪融資���;今年6月����,科濟藥業(yè)正式在港交所上市��;今年7月�,科濟藥業(yè)完成了兩款CAR-T候選產(chǎn)品的對外授權(quán)。目前�,科濟藥業(yè)已布局了十余條在研管線,適應(yīng)癥涵蓋多發(fā)性骨髓瘤����、胃癌/胰腺癌���、干細胞癌等。該公司針對CLDN18.2的自體CAR-T候選產(chǎn)品CT041目前已獲得美國FDA��、中國NMPA和加拿大衛(wèi)生部批準(zhǔn)進行臨床試驗�����。CT041曾于去年獲得美國FDA授予的孤兒藥資格(ODD)�,用于治療胃癌/胃食管結(jié)合部癌。今年�,CT041又先后被歐洲藥品管理局(EMA)授予孤兒藥資格和優(yōu)先藥品(PRIME)資格,用于治療胃癌�����。根據(jù)新聞稿介紹���,CT041是全球首個入選PRIME計劃的實體瘤CAR-T產(chǎn)品��。下表為全球知名投行Torreya于2021年11月5日發(fā)布的亞洲最具價值TOP20生物醫(yī)藥公司,摘自《全球1000強藥企報告》���。▲亞洲最具價值TOP20生物醫(yī)藥公司(20 Most Valuable Biotechs in Asia)榜單——Torreya�,2021年11月5日
文章來源:創(chuàng)鑒匯