中國國家藥監(jiān)局藥品審評中心(CDE)網(wǎng)站公示顯示���,輝瑞(Pfizer)申報的elranatamab獲得一項臨床試驗默示許可���,擬用于以下適應癥:單藥或聯(lián)合達雷妥尤單抗�,用于既往接受過至少1線抗多發(fā)性骨髓瘤治療(包括來那度胺和蛋白酶體抑制劑)的多發(fā)性骨髓瘤患者��。公開資料顯示�,elranatamab是一款靶向BCMA和CD3的雙特異性抗體藥物,在全球已進入3期臨床研究階段�。

B細胞成熟抗原(BCMA)是TNF受體超家族中的一員,主要表達在多發(fā)性骨髓瘤細胞系及多發(fā)性骨髓瘤患者的細胞中���,且表達呈現(xiàn)出隨著疾病的進展而增加的特點�,因此成為了治療多發(fā)性骨髓瘤的理想靶點��。根據(jù)輝瑞公司此前公開資料介紹��,elranatamab(PF-06863135)是一款皮下注射�、靶向BCMA和CD3的雙特異性抗體,它的一端與BCMA相結(jié)合�,另一端與T細胞表面的CD3受體結(jié)合,從而可以激活T細胞殺傷表達BCMA的癌細胞�。此前,elranatamab已經(jīng)在一項治療復發(fā)/難治性多發(fā)性骨髓瘤患者的1期臨床試驗中證明了其安全性和對多發(fā)性骨髓瘤的高緩解率���,接受劑量為每周1000 μg/kg治療的患者中83%獲得應答���。此外該藥所有皮下注射的劑量水平的安全性均可控���,未觀察到劑量限制性毒性。2021年1月�,elranatamab獲得美國FDA授予的快速通道資格,用于治療復發(fā)/難治性多發(fā)性骨髓瘤���。
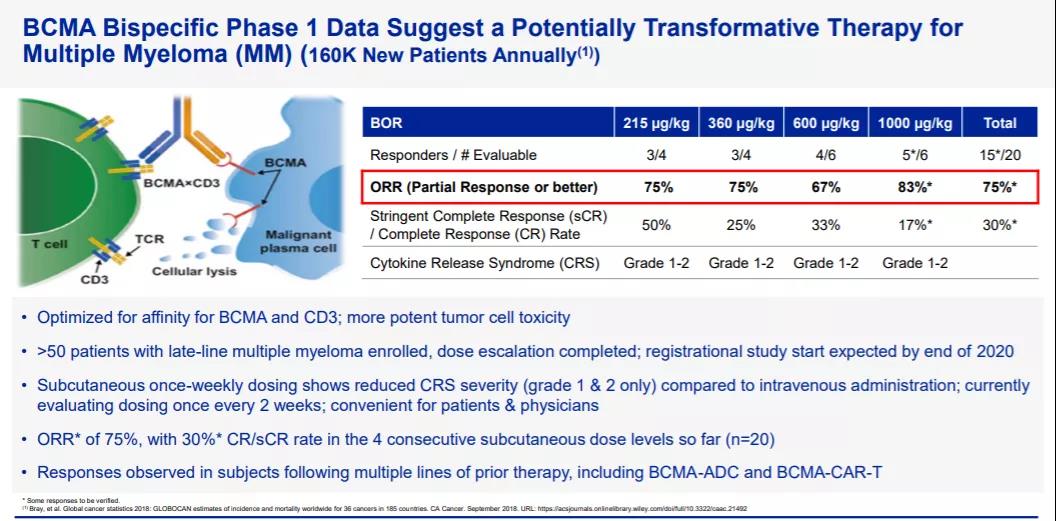
▲elranatamab簡介(圖片來源:輝瑞公司官網(wǎng))
ClinicalTrials官網(wǎng)顯示�,目前elranatamab正在針對多發(fā)性骨髓瘤患者開展多項2期或3期臨床研究�。其中��,一項名為MagnetisMM-5的3期臨床研究已經(jīng)于2021年8月開始進行��,該研究將評估elranatamab單藥或聯(lián)合達雷妥尤單抗注射液��,對既往接受過至少1線抗多發(fā)性骨髓瘤治療(包括來那度胺和蛋白酶體抑制劑)的復發(fā)/難治性多發(fā)性骨髓瘤患者的療效和安全性�。在中國,elranatamab此前已獲得一項臨床試驗默示許可�。目前,該產(chǎn)品正在三重難治性多發(fā)性骨髓瘤患者中進行一項評估安全性���、藥代動力學��、藥效學和療效的1b/2期開放性研究��。希望輝瑞公司elranatamab在臨床開發(fā)中進展順利���,早日為更多多發(fā)性骨髓瘤患者帶來新的治療選擇�。
參考資料:
[1]中國國家藥監(jiān)局藥品審評中心官網(wǎng)-臨床試驗默示許可.Retrieved Jan 19,2022,from https://www.cde.org.cn/main/xxgk/listpage/4b5255eb0a84820cef4ca3e8b6bbe20c
[2] Oncology. Retrieved February 2, 2021, from https://s21.q4cdn.com/317678438/files/doc_presentations/2020/09/Oncology_FINAL.pdf
[3] Pfizer Initiates Pivotal Phase 2 MagnetisMM-3 Trial of BCMA-CD3 Bispecific Antibody Elranatamab (PF-06863135) in Multiple Myeloma. Retrieved Feb 17,2021,from https://www.pfizer.com/news/press-release/press-release-detail/pfizer-initiates-pivotal-phase-2-magnetismm-3-trial-bcma
文章來源:醫(yī)藥觀瀾



